Компания «Сколтех» выявила один из механизмов, с помощью которого бактериофаги (вирусы, уничтожающие бактерии) помогают бороться с опасными для человека патогенами. Это замечательное достижение в области разработки альтернатив антибиотикам.
Взлет и падение антибиотиков
В 1928 г. британский микробиолог Александр Флеминг выделил вещество, убивающее бактерии, из обычной плесени, растущей на черством хлебе. Он назвал его пенициллином. Это был первый антибиотик, массовое производство которого началось в 1943 году.
Это был прорыв в медицине.
До этого времени целые регионы были опустошены эпидемиями чумы, холеры, сибирской язвы, огромное количество людей умирало от заражения крови и раневых инфекций во время войн и стихийных бедствий. Этому пришел конец.
С 1950-х по 1970-е годы фармакологи многих стран активно создавали новые противомикробные препараты. Казалось, что опасные бактериальные инфекции навсегда ушли в прошлое.
Однако уже через несколько месяцев бактерии становятся устойчивыми к любому антибиотику. Каким бы мощным ни был препарат, многие микроорганизмы выживают благодаря определенным мутациям. Рано или поздно формируется устойчивая популяция, и лекарство становится неэффективным
Это был прорыв в медицине.
До этого времени целые регионы были опустошены эпидемиями чумы, холеры, сибирской язвы, огромное количество людей умирало от заражения крови и раневых инфекций во время войн и стихийных бедствий. Этому пришел конец.
С 1950-х по 1970-е годы фармакологи многих стран активно создавали новые противомикробные препараты. Казалось, что опасные бактериальные инфекции навсегда ушли в прошлое.
Однако уже через несколько месяцев бактерии становятся устойчивыми к любому антибиотику. Каким бы мощным ни был препарат, многие микроорганизмы выживают благодаря определенным мутациям. Рано или поздно формируется устойчивая популяция, и лекарство становится неэффективным

За последние несколько десятилетий появились чрезвычайно устойчивые штаммы бактерий, известные как «супербактерия»: По данным ВОЗ, в настоящее время каждый десятый человек в мире умирает от устойчивых бактерий. Еще больше людей умирает от сердечно-сосудистых заболеваний и инсультов.
Бактериальный иммунитет.
Поэтому мы напоминаем о фаготерапии, т. е. лечении бактериофагами — собственными вирусами бактерий. Этот метод применялся в 1920−30-х годах, но только в крайнем случае против бактерий с множественной лекарственной устойчивостью.
Затем в медицинском сообществе наступил «фаговый ренессанс». Во многих странах были созданы банки бактериофагов, ученые изучают различные аспекты взаимодействия бактериальных вирусов и их хозяев. Цель — модификация вирусных частиц для создания фагов, эффективных против конкретного патогена или группы патогенов.
Для этого необходимо понять биологические механизмы, с помощью которых бактерии защищаются от вирусной инфекции, и то, как бактериофаги преодолевают эту защиту. Соответствующие исследования уже несколько лет ведутся в Сколковском институте науки и технологий (Сколтех).
Затем в медицинском сообществе наступил «фаговый ренессанс». Во многих странах были созданы банки бактериофагов, ученые изучают различные аспекты взаимодействия бактериальных вирусов и их хозяев. Цель — модификация вирусных частиц для создания фагов, эффективных против конкретного патогена или группы патогенов.
Для этого необходимо понять биологические механизмы, с помощью которых бактерии защищаются от вирусной инфекции, и то, как бактериофаги преодолевают эту защиту. Соответствующие исследования уже несколько лет ведутся в Сколковском институте науки и технологий (Сколтех).
Фаги — самые распространенные биологические объекты на планете. Их количество примерно в десять раз превышает количество бактерий. Бактерии выработали многочисленные противовирусные стратегии или иммунные системы, поскольку на протяжении всей своей жизни постоянно подвергаются атакам фагов. По оценкам ученых, существует не менее 100 различных видов фагов. Одни из них очень распространены и действуют на большие группы вирусов, другие — очень специфичны.

Но в целом отношения между вирусами и бактериями можно сравнить с гонкой вооружений. По мере того как бактерии осваивают новые стратегии защиты, на противоположную сторону оказывается сильное давление. В конце концов, появляются варианты фагов, которые каким-то образом научились противостоять иммунитету бактерий. «Активная конкуренция приводит к формированию многочисленных противовирусных систем, — поясняют ученые.
Одни из них препятствуют проникновению вирусов в бактериальные клетки, модифицируя рецепторы на поверхности бактерий, другие уничтожают чужеродную ДНК, уже присутствующую в бактериях (системы рестрикции-модификации или суперинфекции-исключения). Иногда бактериальные клетки могут даже совершать самоубийство, чтобы ограничить число вирусных потомков (система абортивной инфекции).
Одни из них препятствуют проникновению вирусов в бактериальные клетки, модифицируя рецепторы на поверхности бактерий, другие уничтожают чужеродную ДНК, уже присутствующую в бактериях (системы рестрикции-модификации или суперинфекции-исключения). Иногда бактериальные клетки могут даже совершать самоубийство, чтобы ограничить число вирусных потомков (система абортивной инфекции).

Но наиболее ярким примером является система CRISPR/Cas. Бактерии «пишут» свой геном и передают своему потомству информацию о фагах, с которыми они сталкиваются в течение жизни. Такая «память» позволяет бактериям распознавать фаговую ДНК и эффективно противостоять повторным инфекциям.
В случае с CRISPR, — поясняет Исаев, — бактерии программируют белки Cas только на определенные молекулы ДНК, присутствующие в вирусном геноме. — Это что-то вроде адаптивного иммунитета". Когда клетка встраивает фрагмент ДНК фага в свой геном, все ее потомки будут знать о встрече с этим патогеном. Это похоже на иммунитет на уровне популяции".
В случае с CRISPR, — поясняет Исаев, — бактерии программируют белки Cas только на определенные молекулы ДНК, присутствующие в вирусном геноме. — Это что-то вроде адаптивного иммунитета". Когда клетка встраивает фрагмент ДНК фага в свой геном, все ее потомки будут знать о встрече с этим патогеном. Это похоже на иммунитет на уровне популяции".
Стремление к Нобелевской премии
Микробиологи, изучавшие системы рестрикционной модификации и предложившие использовать их в молекулярной генетике, были удостоены Нобелевской премии по физиологии и медицине в 1978 г., а в 2020 г. такой же чести будут удостоены ученые, открывшие способ применения принципов CRISPR/Cas для редактирования генома. В Сколтехе одновременно изучаются несколько бактериальных иммунных систем.
«Так что как минимум одна Нобелевская премия будет», — шутит глава института. — Мы будем выбирать новые, еще не изученные системы, которые, на наш взгляд, будут наиболее интересны нам, интересоваться механизмами их действия и изучать их эволюционные аспекты — как они возникли и как они полезны для бактерий. Мы также пытаемся понять, как вирусы обходят бактериальный иммунитет".
Каждая клетка использует одновременно несколько иммунных систем, и для надежного преодоления этих многоуровневых линий защиты необходимо создать дизайнерские фаги, эффективные против всех патогенных систем одновременно.
Каждая клетка использует одновременно несколько иммунных систем, и для надежного преодоления этих многоуровневых линий защиты необходимо создать дизайнерские фаги, эффективные против всех патогенных систем одновременно.
Компания Сколтех завершила исследования иммунной системы BREX (от английского bacteriophage elimination), одного из защитных механизмов бактерий, борющихся с фагами. Результаты показали, что бактериофаги могут инфицировать бактерии с защитой BREX, а также с системой рестрикционной модификации I, если они экспрессируют специальный фермент SAM-лиазу, разрушающий S-аденозилметионин (SAM) - важный внутриклеточный метаболит бактериальных клеток.
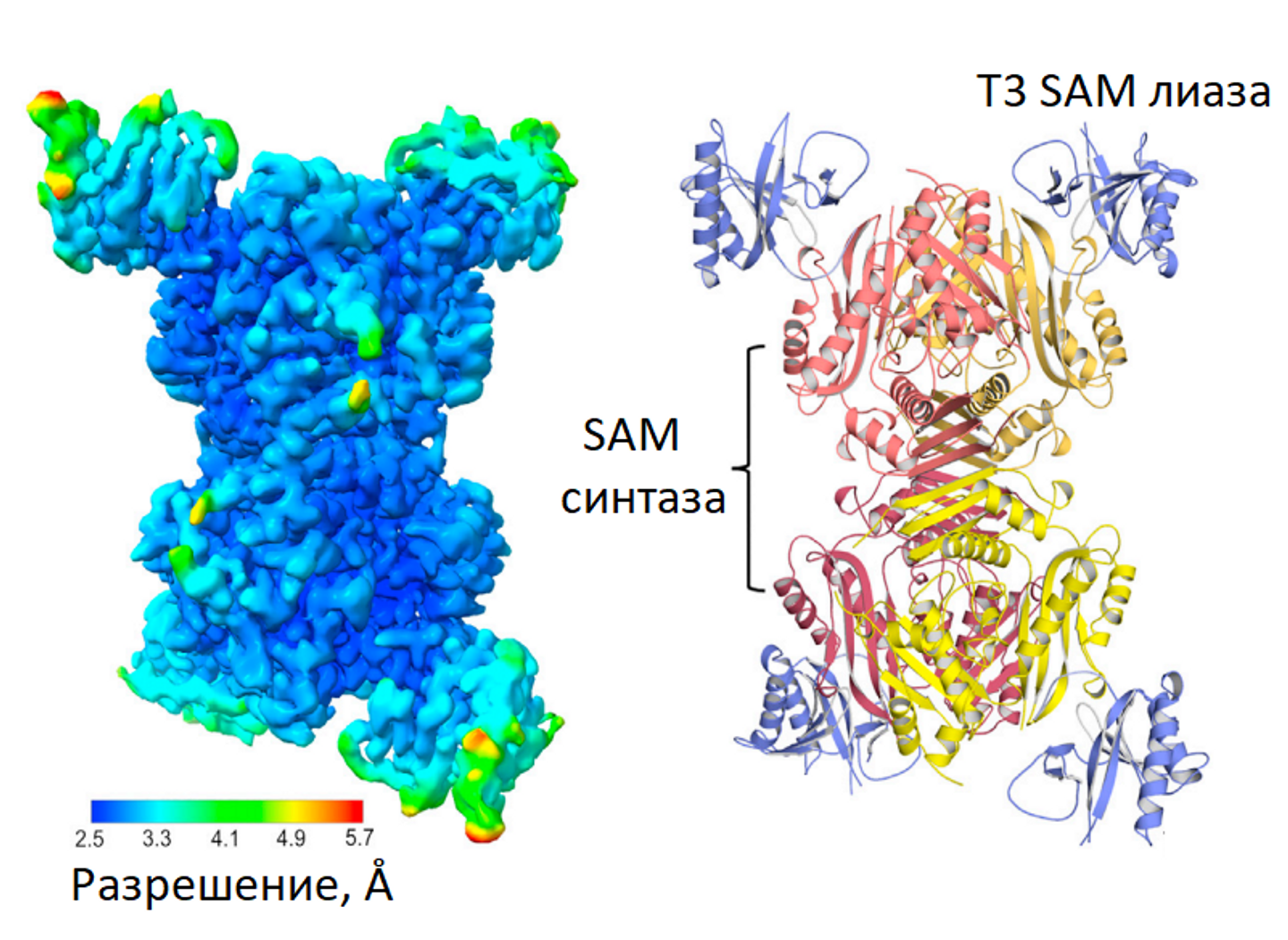
Исаев сказал: «Нам удалось изучить довольно распространенную защитную систему, встречающуюся примерно у 10% бактерий, и понять, как определенный бактериофаг T3 с антизащитным белком преодолевает ее». — Без этого белка бактериальный иммунитет просто не работает".
«Интересно, что ген, кодирующий SAM-лиазу, стоит первым в последовательности генов фага T3. Когда фаг Т3 попадает в клетку, он сразу же выполняет свою основную задачу. В противном случае вирусная ДНК была бы немедленно распознана и уничтожена», — продолжает ученый.
«Интересно, что ген, кодирующий SAM-лиазу, стоит первым в последовательности генов фага T3. Когда фаг Т3 попадает в клетку, он сразу же выполняет свою основную задачу. В противном случае вирусная ДНК была бы немедленно распознана и уничтожена», — продолжает ученый.

Обнаружив брешь в одной из защитных систем бактерий, российские ученые сделали еще один шаг к поиску новых способов борьбы с опасными инфекциями. В мире уже открыто около 30 таких систем, и их изучение продолжается.
Я думаю, что в течение десяти лет мы увидим практические результаты", — говорят исследователи. — Фундамент для нового поколения фаговых терапий уже заложен. Ранее фаги использовались практически вслепую, без знания механизма их действия.
Я думаю, что в течение десяти лет мы увидим практические результаты", — говорят исследователи. — Фундамент для нового поколения фаговых терапий уже заложен. Ранее фаги использовались практически вслепую, без знания механизма их действия.
Альтернатива антибиотикам
Клинические испытания фагов проводились во многих странах, в том числе и в России. Основной вывод — бактериальные вирусы не опасны для организма человека. Фаги можно вводить в кровь, принимать перорально или наносить на раны в виде аэрозолей. Они не вторгаются в клетки человека, не вызывают воспалительных реакций и не нарушают полезную микрофлору организма.
Однако для того чтобы охарактеризовать даже один вирус и изучить его взаимоотношения с бактериями, необходимо провести большое количество исследований. Поэтому во многих странах созданы банки бактериофагов. В будущем, если появятся новые бактерии, устойчивые к антибиотикам, эти банки можно будет скринировать за один день и создавать из модулей дизайнерские фаги для любого патогена.
Однако для того чтобы охарактеризовать даже один вирус и изучить его взаимоотношения с бактериями, необходимо провести большое количество исследований. Поэтому во многих странах созданы банки бактериофагов. В будущем, если появятся новые бактерии, устойчивые к антибиотикам, эти банки можно будет скринировать за один день и создавать из модулей дизайнерские фаги для любого патогена.
Источник: ria.ru









